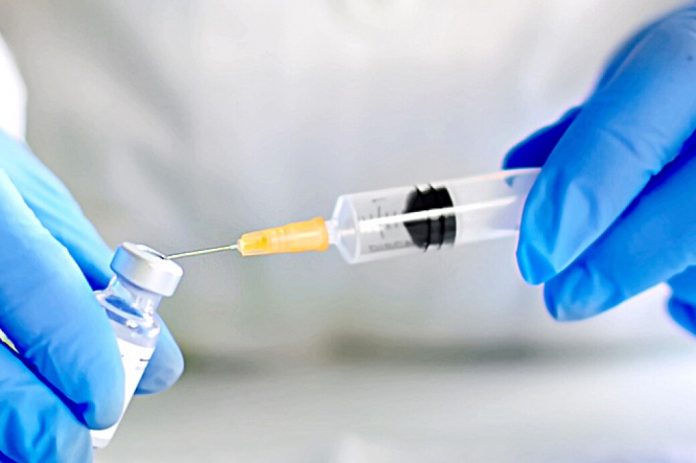
Dacă un vaccin împotriva noului coronavirus va fi autorizat în Statele Unite înainte de sfârşitul anului 2020, participanţii care au primit placebo în cadrul studiilor clinice vor solicita ei oare imediat şi în număr foarte mare vaccinul aprobat? Această întrebare îi preocupă pe reprezentanţii autorităţilor sanitare şi ai companiilor farmaceutice, întrucât ieşirea voluntarilor din astfel de studii ar complica procedura de evaluare pe termen lung a vaccinurilor.
În prezent, zeci de mii de persoane din Statele Unite şi din alte ţări au acceptat să devină voluntari care participă la studii clinice de fază 3. În general, jumătate dintre voluntari primesc un vaccin experimental, iar cealaltă jumătate alcătuiesc grupul placebo.
Scopul este acela de a observa, de-a lungul mai multor luni, câte persoane din fiecare grup contractează apoi pe cale naturală noul coronavirus şi se îmbolnăvesc de COVID-19. Dacă reducerea (numărului de persoane care se îmbolnăvesc, n.r.) depăşeşte 50% în grupul vaccinat în raport cu grupul martor, atunci Agenţia americană pentru alimente şi medicamente (FDA) ar putea să considere vaccinul eficient şi să îi acorde ceea ce se numeşte o autorizaţie de utilizare în regim de urgenţă.
Dar, pentru o autorizaţie permanentă, FDA are nevoie de o perioadă de monitorizare mai lungă, în general de şase luni, pentru a confirma inocuitatea vaccinului, întrucât anumite efecte secundare şi rare nu pot fi detectate în primele două luni de monitorizare, prevăzute în legislaţia actuală ce vizează autorizaţia condiţionată.
Problema este că, în general, din motive etice, odată ce un medicament sau un vaccin este autorizat, participanţii care au primit placebo într-un studiu clinic sunt informaţi în această privinţă. Ei ar putea atunci să solicite adevăratul vaccin sau, într-o manieră independentă, să meargă la diverse clinici pentru a se vaccina. Dacă fac acest lucru, grupul placebo se micşorează, fapt ce ar împiedica realizarea unei comparaţii pe termen lung între grupul vaccinat şi grupul placebo.
Riscul este încă şi mai mare pentru zecile de proiecte care nu au demarat încă testele lor pe scară amplă: Cine îşi va asuma riscul de a primi placebo, dacă un vaccin este deja disponibil în farmacii? Subiectul a fost discutat joi în cadrul unei reuniuni a comitetului consultativ al FDA pentru vaccinuri, care nu a găsit însă o soluţie reală.
Doran Fink, membru al biroului pentru vaccinuri din cadrul FDA, a afirmat că studiile ar putea continua în populaţiile pentru care niciun vaccin nu a fost încă autorizat sau pentru care nicio doză de vaccin nu este încă disponibilă. Dar, pentru majoritatea populaţiei, dilema este cât se poate de reală.
Oamenii pun întrebări
„Suntem conştienţi că ar putea să apară anumite situaţii în care nu mai este permis din punct de vedere etic, şi deci nu mai este fezabil, să continuăm monitorizarea grupurilor placebo într-un studiu sau să începem un studiu controlat prin intermediul unui grup placebo” a recunoscut Doran Fink.
„Nu am o soluţie pentru această problemă specifică. În acest stadiu, am cerut producătorilor de vaccinuri şi altor agenţii guvernamentale implicate în studiile clinice să reflecteze la o modalitate prin care ar putea să îi păstreze pe voluntari în testele clinice”, a precizat el.
Una dintre cele două companii americane ce mizează pe depunerea unei solicitări de autorizare condiţionată până la sfârşitul lunii noiembrie în Statele Unite, Moderna (cealaltă este Pfizer), a cerut în mod oficial instrucţiuni din partea autorităţilor federale.
„Participanţii (la studiile clinice, n.r.) încep deja să ne întrebe despre momentul în care vor putea să afle dacă au primit un vaccin, sau placebo”, a dezvăluit Jacqueline Miller, vorbind în numele companiei Moderna.
Reprezentanţii grupului Pfizer şi ai partenerul său german BioNTech au trimis la rândul lor o scrisoare către FDA în care au afirmat că au „responsabilitatea etică” de a îi informa pe membrii grupului placebo şi au cerut agenţiei americane să fie „deschisă” în faţa altor metode pentru a putea continua să evalueze vaccinurile.
Pentru moment, FDA a formulat o singură dispoziţie în această privinţă: continuaţi studiile, atât timp cât acest lucru rămâne „fezabil”.